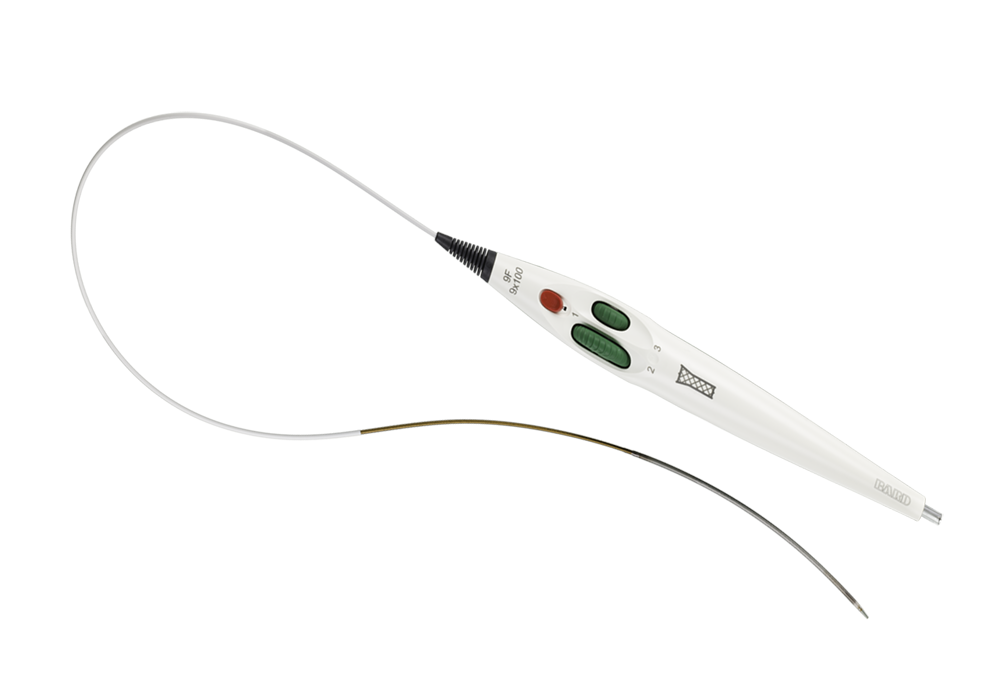
Endoprothèse vasculaire couverte Covera™
La SEULE endoprothèse couverte indiquée pour les greffes AV et les fistules AV natives***


- Présentation
- Expérience clinique
- Mode d’emploi en version électronique et ressources
L’endoprothèse couverte sur mesure pour les patients AV
L’endoprothèse vasculaire couverte™ s’appuie sur des technologies éprouvées du leader de la catégorie des accès AV. Cette plateforme d’endoprothèse couverte est conçue pour équilibrer la flexibilité et la résistance nécessaires pour traiter les lésions difficiles de l’arc céphalique terminal, aux segments basiliques du point d’oscillation, jusqu’à l’anastomose veineuse du greffon AV. Les configurations évasées et droites permettent un dimensionnement et une adaptation précis à la paroi vasculaire, tandis qu’un système de mise en place à molette facile à utiliser avec deux options de vitesse permet de contrôler la mise en place.
L’endoprothèse vasculaire couvert Covera™ a donné des résultats efficaces dans deux essais cliniques distincts, l’un pour les patients dialysés avec des greffons AV et l’autre pour les patients dialysés avec des fistules AV.1
Force et flexibilité radiales
Architecture unique et flexible de l’endoprothèse de base conçue pour s’adapter au vaisseau natif dans les anatomies AV difficiles.

- 1
- 2
- 3
- 4
- 5
Bords profilés conçus pour optimiser l’apposition de la paroi et favoriser le flux laminaire
Imprégnation au carbone dans toute la lumière pour réduire l’adhésion des plaquettes au stade précoce
Conçu pour la flexion, la compression et la torsion avec supports hélicoïdaux et ponts coudés
Encapsulation complète entre deux couches ePTFE conçues pour résister à l’hyperplasie néointimale dans la zone de traitement
Marqueurs au tantale pour une haute visibilité sous fluoroscopie

- La configuration droite est destinée à une utilisation dans des anatomies où le diamètre du vaisseau d’évacuation est inférieur ou égal à celui du vaisseau d’entrée
- La configuration évasée est destinée à une utilisation dans des anatomies où le diamètre du vaisseau d’évacuation est supérieur à celui du vaisseau d’entrée

Embout atraumatique conçu pour faciliter l’insertion et le retrait au niveau du site d’accès
Facilite un contrôle précis de la mise en place
Système de mise en place triaxiale intuitif conçu pour une mise en place précise et pour faciliter une couverture optimale de la lésion
- 1
- 2
- 3
Gaine de stabilité pour une mise en place lisse et précise
Molettes à deux vitesses pour un bon contrôle par l’opérateur
Poignée ergonomique pour un déploiement à une main
***Aux États-Unis à compter de janvier 2023
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Étude clinique multicentrique prospective de l’endoprothèse vasculaire couverte Covera™ dans le traitement de la sténose à l’anastomose veine-greffon des greffons d’accès d’hémodialyse dysfonctionnels. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi :10.1016/j. jvir.2022.02.008. Étude clinique AVeNEW, Données archivées. À 6 mois dans AVeVA, la perméabilité primaire cible de la lésion était de 70,3 % (analyse proportionnelle). À 6 mois dans AVeNEW, le TLPP était de 78,7 % pour l’endoprothèse vasculaire couverte Covera™ contre 47,9 % pour l’ATP seule, P < 0,001. 130 des 142 (91,5 %) sujets randomisés dans le groupe de l’endoprothèse vasculaire Covera™ et 123 des 138 (89,1 %) randomisés pour une ATP ont terminé leur suivi à 6 mois. Le TLPP est défini comme l’intervalle suivant l’intervention d’index jusqu’à la prochaine réintervention clinique sur ou à proximité du site de traitement d’origine ou jusqu’à ce que l’extrémité soit abandonnée pour un accès permanent. Dans AVeNEW, le TLPP à 6 mois – Analyse de sous-groupes est fournie sous forme de données observationnelles sans les valeurs de P. Dans AVeNEW, les patients qui ont reçu l’endoprothèse vasculaire couverte Covera™ ont subi 103 réinterventions impliquant une nouvelle lésion contre 72 réinterventions dans le groupe ATP uniquement à 24 mois. À 30 jours, l’absence d’événements de sécurité primaires était de 96,4 % dans l’AVeVa et de 95,0 % dans l’endoprothèse vasculaire couverte Covera™ contre 96,4 % (ATP seule) dans l’AVeNEW (P <0,0022). L’absence d’événements de sécurité primaires a été définie comme l’absence d’événement indésirable impliquant le circuit d’accès ayant entraîné une intervention supplémentaire, une chirurgie, une hospitalisation ou le décès.
Veuillez lire le mode d’emploi pour connaître les indications, les contre-indications, les avertissements, les précautions, les complications, les événements indésirables et les informations de sécurité détaillées.
BD-23522v2
L’endoprothèse vasculaire couverte Covera™ a été conçue pour traiter les lésions difficiles dans le circuit d’accès AV, notamment l’arcade céphalique terminale, les segments basiliques de point oscillant et l’anastomose veine-greffon.
L’endoprothèse vasculaire couverte Covera™ a donné des résultats efficaces dans deux essais cliniques distincts, un pour les patients dialysant avec des greffons AV et un pour les patients dialysant avec des fistules AV, qui ont tous deux démontré les avantages de cette conception innovante.1
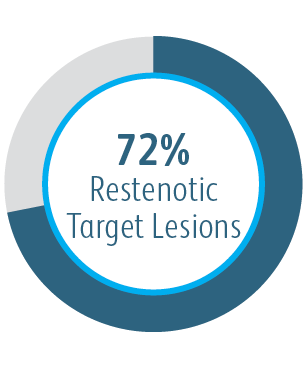
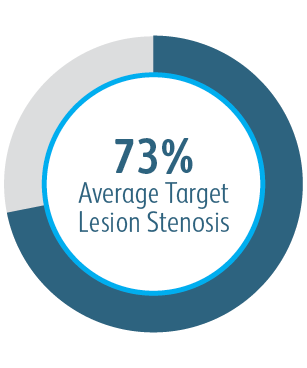
AVeVA était une étude prospective, non randomisée, à un seul bras, multicentrique portant sur l’endoprothèse vasculaire couverte Covera™ utilisée pour traiter les sténoses au niveau de l’anastomose d’un greffon artério-veineux et d’une veine sortante. 110 patients ont été traités avec l’endoprothèse vasculaire couverte Covera™ dans 14 sites de recherche aux États-Unis
L’étude clinique AVeVA a démontré que l’endoprothèse vasculaire couverte Covera™ est efficace dans le traitement des sténoses au niveau de l’anastomose de greffe veineuse des patients dialysés avec une greffe AV.
| Plan de l’étude | Prospective, non randomisée, multicentrique, à un seul bras |
| Objectif | Évaluer la sécurité et l’efficacité de l’endoprothèse vasculaire couverte Covera™ dans le traitement des lésions sténosées lors de l’anastomose veine-greffe des patients hémodialysés dialysés avec un greffon AV |
| Statut | Suivi à 24 mois terminé |
| Nombre de patients/sites | 110 patients ont été traités avec l’endoprothèse vasculaire couverte Covera™ dans 14 sites de recherche aux États-Unis |
| Critère d’efficacité principal | Perméabilité primaire de la lésion cible (TLPP) à 6 mois. |
| Critère de sécurité principal | Absence d’événement indésirable impliquant le circuit d’accès entraînant une intervention supplémentaire, une intervention chirurgicale, une hospitalisation ou un décès à 30 jours |
| Suivi | 30 et 90 jours; 6, 12, 18 et 24 mois |
Perméabilité primaire des lésions cibles à 6 mois après traitement des sténoses anastomoses d’une greffe d’AV avec des greffes d’endoprothèse BD
Ce tableau est destiné uniquement à des fins éducatives et non à des fins de comparaison. Les différences dans le plan de l’étude peuvent affecter les résultats. Consulter des manuscrits complets pour obtenir des détails complets sur le plan de l’étude.
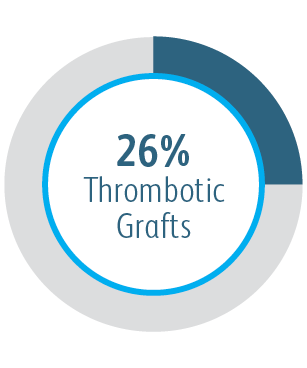
Au cours de l’étude clinique AVeVA, l’endoprothèse vasculaire couverte Covera™ a été étudiée au sein d’une cohorte de patients difficile.
| Plan de l’étude | Prospective, multicentrique, randomisée, à contrôle simultané |
| Objectif | Évaluer la sécurité et l’efficacité de l’endoprothèse vasculaire couverte Covera™ pour le traitement des lésions sténosées dans l’écoulement veineux des membres supérieurs du circuit d’accès AV des patients hémodialysés dialysés avec une fistule AV |
| Statut | Suivi à 24 mois terminé |
| Nombre de patients/sites | 280 sujets randomisés dans 24 sites de recherche (États-Unis, UE, & ANZ) |
| Critère d’efficacité principal | Perméabilité primaire de la lésion cible (TLPP) à 6 mois. |
| Critère de sécurité principal | Absence de tout événement de sécurité grave défini par le protocole impliquant le circuit d’accès AV pendant 30 jours |
| Suivi | À la sortie de l’hôpital, 30 et 90 jours; 6, 12, 18 et 24 mois |
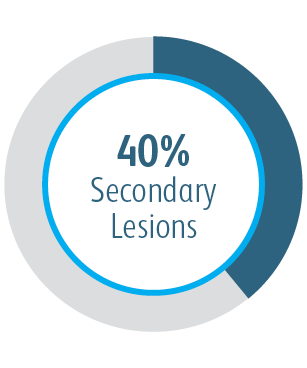
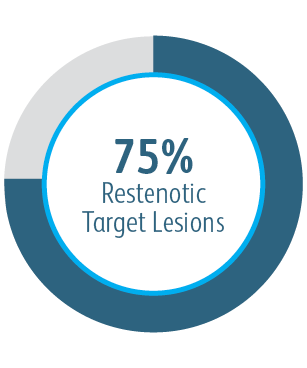
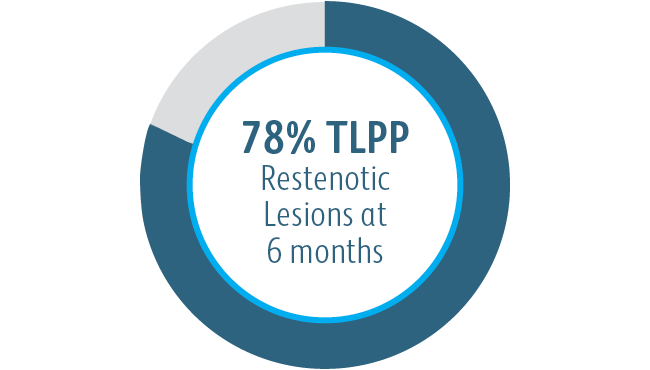
Au cours de l’étude clinique AVeNEW, l’endoprothèse vasculaire couverte Covera™ a été utilisée dans le traitement d’une population de patients difficiles présentant des caractéristiques de lésions difficiles.
À 6 & 12 mois, l’endoprothèse vasculaire couverte Covera™ était supérieure au groupe de contrôle de l’ATP en ce qui concerne le traitement des sténoses dans l’écoulement veineux de patients dialysés avec une fistule artérioveineuse.
Tous les sous-groupes ont montré des bénéfices à 6 mois
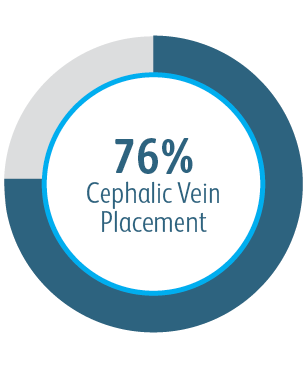
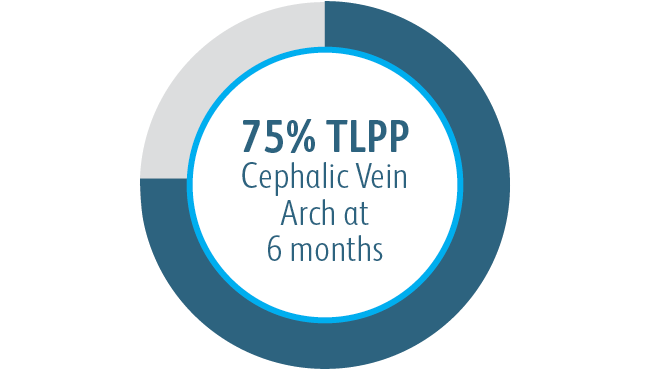
Dans tous les sous-groupes de localisation des lésions cibles analysés, l’endoprothèse vasculaire couverte Covera™ a montré une plus grande perméabilité primaire de la lésion cible par rapport à l’ATP seule, y compris ceux traités au niveau de l’arcade de la veine céphalique.
Critères d’évaluation supplémentaires de l’étude clinique AVeNEW
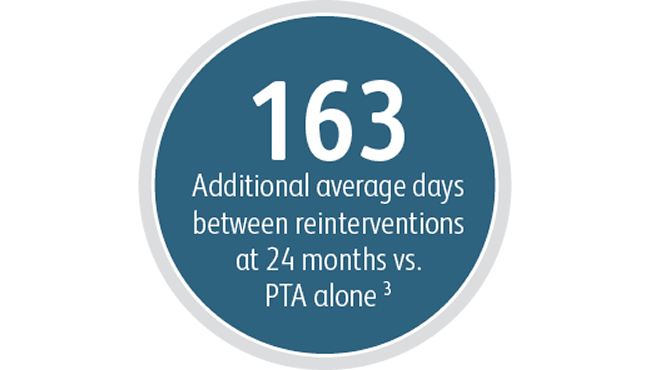
Outre les avantages pour la perméabilité primaire de la lésion cible, l’endoprothèse vasculaire couverte Covera™ a démontré un degré élevé de réussite technique aiguë et prolongé la durée moyenne entre les interventions sur la lésion cible par rapport à l’ATP seule.
Au cours de l’étude clinique AVeNEW, 77 patients présentant des sténoses dans l’arcade de la veine céphalique ont été traités avec l’
endoprothèse vasculaire couverte Covera™.
Dans cet exemple, l’angiographie de référence montre le rétrécissement vasculaire et la réussite technique aiguë avec restauration du vaisseau et conformabilité de l’endoprothèse couverte.
* Haskal ZJ, Trerotola S, Dolmatch B, et al. Stent graft versus balloon angioplasty for failing dialysis-access grafts. N Engl J Med. 2010 Feb 11;362(6):494-503.
** Haskal ZJ, Saad TF, Hoggard JG, et al. Prospective, randomized, concurrently-controlled study of a stent graft versus balloon angioplasty for treatment of arteriovenous access graft stenosis: 2-year results of the RENOVA study. J Vasc Interv Radiol. 2016 Aug;27(8):1105-1114.e3.
***In U.S. as of Nov. 2022
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, multicenter clinical study of the Covera™ Vascular Covered Stent in the treatment of stenosis at the graft-vein anastomosis of dysfunctional hemodialysis access grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. Étude clinique AVeNEW, données archivées. À 6 mois dans AVeVA, la perméabilité primaire cible de la lésion était de 70,3 % (analyse proportionnelle). À 6 mois dans AVeNEW, le TLPP était de 78,7 % pour l’endoprothèse vasculaire couverte Covera™ contre 47,9 % pour l’ATP seule, P < 0,001. 130 des 142 (91,5 %) sujets randomisés dans le groupe de l’endoprothèse vasculaire Covera™ et 123 des 138 (89,1 %) randomisés pour une ATP ont terminé leur suivi à 6 mois. Le TLPP est défini comme l’intervalle suivant l’intervention d’index jusqu’à la prochaine réintervention clinique sur ou à proximité du site de traitement d’origine ou jusqu’à ce que l’extrémité soit abandonnée pour un accès permanent. Dans AVeNEW, le TLPP à 6 mois - Analyse de sous-groupes est fournie sous forme de données observationnelles sans les valeurs de P. Dans AVeNEW, les patients qui ont reçu l’endoprothèse vasculaire couverte Covera™ ont subi 103 réinterventions impliquant une nouvelle lésion contre 72 réinterventions dans le groupe ATP uniquement à 24 mois. À 30 jours, l’absence d’événements de sécurité primaires était de 96,4 % dans l’AVeVa et de 95,0 % dans l’endoprothèse vasculaire couverte Covera™ contre 96,4 % (ATP seule) dans l’AVeNEW (P <0,0022). L’absence d’événements de sécurité primaires a été définie comme l’absence d’événement indésirable impliquant le circuit d’accès ayant entraîné une intervention supplémentaire, une chirurgie, une hospitalisation ou le décès.
2 La réussite technique a été définie comme le déploiement de l’implant à l’endroit prévu, de l’avis de l’utilisateur, évalué au moment de la procédure d’indexation. Étude clinique AVeNEW. Données archivées. Bard Peripheral Vascular Inc., Tempe, AZ.
3L’Indice de perméabilité au niveau de la lésion cible est défini comme étant le temps écoulé entre la procédure d’indexation de l’étude et l’abandon complet de l’accès, divisé par le nombre de visites pour une nouvelle intervention réalisée au niveau de la lésion cible afin de préserver l’accès vasculaire pour l’hémodialyse. IPF-T moyen de 380,40 jours avec l’endoprothèse vasculaire couverte Covera™ contre 217,57 jours avec une ATP seule à 24 mois. Étude clinique AVeNEW. Données archivées. Bard Peripheral Vascular Inc., Tempe, AZ.
Veuillez lire le mode d’emploi pour connaître les indications, les contre-indications, les avertissements, les précautions, les complications, les événements indésirables et les informations de sécurité détaillées.
BD-23522v2
Le corpus de publications de BD sur le secteur et nos offres vous donnent des informations que vous pouvez utiliser pour continuer à viser l’excellence.
BD met à votre disposition des ressources de formation pour vous aider à améliorer vos pratiques cliniques, dans le cadre de notre objectif « faire progresser le monde de la santé ».
BD soutient le secteur des soins de santé en proposant des produits et des services de pointe pour améliorer les soins tout en diminuant les coûts. Nous organisons des événements et participons à des rencontres qui excellent à faire progresser le monde de la santé, conformément à notre devise « faire avancer le monde de la santé™ ».
BD promeut l’excellence clinique en fournissant diverses ressources sur les bonnes pratiques, les innovations cliniques et les tendances du secteur de la santé.